Kleine Mutation schaltet Schmerzen Sensor von kälteempfindlichen Hot -sensitive
Eis -Liebhaber und heißen Tee-Trinker mit empfindlichen Zähnen eines Tages einen Grund , eine neue Erkenntnis, von der Duke University Forscher feiern. Die Wissenschaftler haben eine sehr kleine Veränderung in einem einzelnen Protein , das einen kälteempfindlichen Rezeptors in eine, die Wärme abfühlt dreht gefunden.
Das Verständnis Gefühl und Schmerz auf dieser Ebene könnte zu mehr spezifischen Schmerzmittel , die keine Auswirkungen hätte das zentrale Nervensystem , wahrscheinlich produzieren weniger schwere Nebenwirkungen als bestehende Medikamente führen , sagte Jörg Grandl , Ph.D., Assistant Professor für Neurobiologie in Herzogs School of Medicine , die die Research-Team .
Temperaturbedingten Schmerzen , die auch als thermische Schmerzen, tritt auf, wenn der Körper die sensorischen Neuronen in Kontakt mit Temperaturen über oder unter einem bestimmten Schwellenwert , wie Eintauchen ein Glied in eiskaltem Wasser .
"Wir wollen verstehen, wie entweder heißen oder kalten Temperaturen können die Sensoren an warmen und kalten Temperaturen im Körper zu aktivieren ", so Grandl .
Zurück Forschung hat transient receptor potential (TRP) Ionenkanäle als sehr empfindlich gegenüber entweder kalt oder warm Temperaturen gekennzeichnet. TRP Ionenkanäle sind poröse Proteine, die eine Rolle bei der Initiierung von elektrischen Signalen durch Steuern des Stroms geladener Ionen durch die Zellmembran spielt.
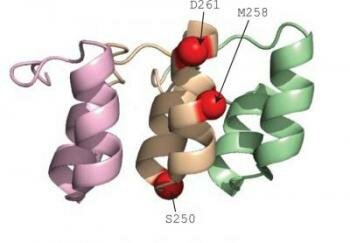
Dieses Band Diagramm zeigt drei Ankyrin -Wiederholungen , eine gemeinsame Struktur in Rezeptorproteine , die entweder kalt oder warm Temperaturen spüren gefunden. Ein Duke -Team hat drei Einzelpunktmutationen, die Temperaturempfindlichkeit invertieren kann , Drehen eines kalt Sensor in einen Wärmesensoridentifiziert. Alle drei Mutationen in einem einzelnen Ankyrin Repeat .
Bildnachweis: Grandl Lab , Duke University
Es ist immer noch unklar, wie Temperaturen , damit dies geschieht , aber die Forschung des Grandl Teams zeigt, dass die Ein-Buchstaben- Veränderungen in der DNA , die so genannte Punktmutationen , ausreichend, um kälteempfindlichen TRP Ionenkanäle empfindlich auf hohe Temperaturen statt geworden sind .
"Es gibt großes Interesse an Verständnis temperaturempfindliche Moleküle aus funktionaler Sicht , weil sie vielversprechende Ziele für die Entwicklung von schmerzlindernden Verbindungen um chronische Schmerzen zu behandeln", sagte Grandl , der auch Mitglied des Duke -Institut für Neurowissenschaften . " . Es ist etwas, was wir noch nicht gut behandeln, ist also eine vielversprechende Strategie , um Schmerzen , wo es ursprünglich erfasst wird, zu stoppen - . In diesem ersten Molekül , das als Sensor des Schmerzes "
In einer Studie, die online in den frühen Zeitschrift Neuron auftreten , konzentriert Grandl -Team auf TRPA1 , ein Ionenkanal besten als Sensor für Schmerzen, die durch Umweltreize und scharfen Chemikalien, wie Senföl verursacht bekannt , wobei der Wirkstoff in Wasabi gefunden.
Grandl Kollegen , Postdoc Sairam Jabba und ForschungstechnikerRaman Goyal , untersucht, ob Ein-Punkt- Mutationen Kalt aktiviert Maus TRPA1 in wärmeaktivierte ändern. Sie bildeten diese Hypothese , da in einigen anderen Tieren , einschließlich Drosophila Fruchtfliegen und Klapperschlangen, TRPA1 natürlich wärme aktiviert.
Um diese Strukturen zu identifizieren , erstellt das Team eine Bibliothek von 12.000 mutierte Klone der Kalt aktiviert Maus TRPA1 Ionenkanal und zufällig eingefügt ein oder zwei Punktmutationen in jedem Klon . Nach dem Aufsetzen einzelne Klone in die einzelnen Schlitze einer 384 -Well-Platte und Erhitzen von 25 Grad Celsius bis 45 C in einer Angelegenheit von Sekunden , waren sie in der Lage , die thermische Empfindlichkeit jedes mutierten Proteins messen.
Dieses Screening lokalisiert sieben Klone, die starke Aktivierung zeigte bei Wärmeeinwirkung . Gen-Sequenzierung dieser Klone ergab, 12 Mutationen , die möglicherweise für die Änderung der Maus TRPA1 aus kalt aktiviert, um Wärme aktivierten verantwortlich sein könnte . Von den insgesamt 12 Mutationen , Jabba und Goyal wurden drei Mutationen stark genug, um individuell zu machen , dass der Schalter in TRPA1 .
Die Mutationen allem erwies sich in einem einzelnen kleinen Domäne des Ionenkanal -Protein als Ankyrin repeat sechs bekannten angebracht werden, das diese Domäne eine Rolle bei der Bestimmung der Kälte oder Hitze -Aktivierung. Ankyrin -Repeats sind oft für die Verwaltung Protein -zu -Protein-Wechselwirkungen verantwortlich sind, aber ihre genaue Funktion in TRPA1 bisher nicht bekannt gewesen.
Interessant ist, dass diese Einzelpunktmutationennicht die Ionenkanäle " Reaktionen auf Chemikalien wie Senföl wechseln.
"Das war sehr überraschend , und es zeigt, dass die Herstellung einer Ein-Punkt- Mutation erzeugt eine tiefgreifende Veränderung in der Temperaturempfindlichkeit des Proteins , aber es hat keinen Einfluss auf die chemische Sensibilität ", sagte Grandl . "Es zeigt, diese Mechanismen zu einem gewissen Grad verschieden. "
Grandl , dass zusammengenommen deuten die Ergebnisse auch, dass die Wirksamkeit eines solchen kleinen Mutation könnte der Schlüssel zu einem einzelnen Vorfahren Ionenkanal entwickelt sich die große Vielfalt von temperaturaktivierten Ionenkanäle , die wir heute sehen können.