Die Kenntnis der wichtigsten Rezeptoren durch Architektur von Signalproteinen verbessert
Ein Team von Wissenschaftlern der Duke Medizin, der University of Michigan und Stanford University hat die zugrunde liegende Architektur eines zellulären Signalkomplexin der Reaktion des Körpers auf Reize wie Licht und Schmerz beteiligt bestimmt.
Dieser Komplex , bestehend aus einer menschlichen Zelloberflächenrezeptorund seine regulatorischen Proteins offenbart einen zweistufigen Mechanismus, der zuvor vermutet wurde, aber nicht direkt dokumentiert.
Die Ergebnisse, die in der Zeitschrift Nature berichtet , eine strukturelle Bilder eines G- Protein-gekoppelten Rezeptor (GPCR ) in Aktion.
" Es ist wichtig, sich vorzustellen, wie diese Rezeptoren funktionieren völlig zu schätzen , wie unser Körper auf eine breite Palette von Stimuli , einschließlich Licht , Hormone und verschiedene Chemikalien zu reagieren", sagte Co- Senior-Autor Robert J. Lefkowitz , MD, der James B. Duke Professor für Medizin an der Duke University School of Medicine und Howard Hughes Medical Institute Investigator .
Lefkowitz ist Co- Senior-Autor mit Georgios Skiniotis , Ph.D., der Jack E. Dixon Collegiate Professor an der Life Sciences Institute an der University of Michigan, und Brian K. Kobilka , MD, der Helene Irwin Fagan Lehrstuhl für Kardiologie an der Stanford University School of Medicine . Lefkowitz und Kobilka teilte die 2012 Nobelpreis für Chemie für ihre Entdeckungen mit GPCRs .
GPCRs sind die größte Familie der Drogen-Ziele für menschliche Krankheiten , einschließlich Herz-Kreislauf -Erkrankungen, neurologische Erkrankungen und verschiedene Krebsarten . Das Protein Beta- Arrestin ist der Schlüssel für die Regelung dieser Rezeptoren , und die Autoren visualisiert ein Komplex des Proteins Beta- Arrestin zusammen mit dem Rezeptor in den "Kampf - oder - Flucht" Reaktion beim Menschen beteiligt.
" Arrestin primäre Aufgabe ist es, die Kappe auf GPCR setzen Signalisierung . Aufklärung der Struktur dieses Komplexes ist entscheidend für das Verständnis, wie die Rezeptoren , um abweichende Signal verhindern desensibilisiert ", sagte Skiniotis .
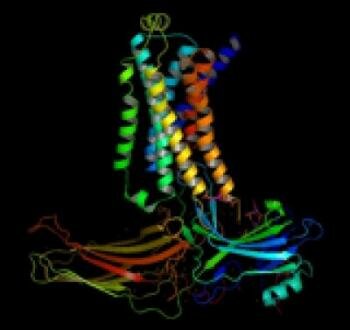
Dies ist ein Strukturmodell des beta2 -adrenergen Rezeptor - Arrestin- Signalkomplex wie durch Elektronenmikroskopie , Vernetzung und Massenspektrometrie abgeleitet .
Credit: Herzog Medicine
" Hochauflösende Anzeige dieser Signalbaugruppeist eine Herausforderung , da die Proteinkomplexe sind transiente und hochdynamische und große Mengen der isolierten Proteine werden für die Versuche erforderlich ", sagte Co-Lead Autor Arun K. Shukla , der mit Lefkowitz an der Duke arbeitete und wird nun die Einrichtung eines unabhängigen Labor in der Abteilung für Biologische Wissenschaften und Bioingenieurwissenschaften am Indian Institute of Technology , Kanpur .
Sobald die Autoren hatten Material zum direkten Strukturvisualisierung, benutzten sie die Elektronenmikroskopie zu zeigen, wie die einzelnen Moleküle dieses Signalbaugruppemit Bezug zueinander organisiert.
Die Forscher dann kombiniert Tausende von Einzelbildern , um ein besseres Bild von der molekularen Architektur zu erzeugen. Sie weiter dieses Bild geklärt durch Vernetzung Analyse und Massenspektrometrie Messungen .
Die Autoren nächstes Ziel ist es, näher zu dieser Montage mittels Röntgenkristallographie , eine Technologie, die auf atomarer Ebene Einblicke in diese Architektur zu offenbaren sollte erhalten. Eine solche atomare Details könnten dann in Experimenten verwendet werden, um neue Medikamente zu entwerfen und zu entwickeln, ein besseres Verständnis der grundlegenden Konzepte in GPCR Biologie.
"Dies ist nur ein Anfang , und es ist ein langer Weg zu gehen", sagte Shukla . "Wir haben ähnliche Komplexe von anderen GPCRs zu visualisieren , um ein umfassendes Verständnis dieser Familie von Rezeptoren zu entwickeln. "