In Antibiotikum Werk der Natur , als Ein-Aus- Schalter wirkt kleines Molekül
Wissenschaftler haben die Entwicklungs -Aus-Schalter für Streptomyces , eine Gruppe von Bodenmikroben , die mehr als zwei Drittel der weltweit natürlich abgeleitete produzieren identifiziert Antibiotikum Medikamenten.
Die Bodenbakterien Streptomyces bilden fadenförmige Äste, die in die Luft zu verlängern , um spiralförmige Türme von Sporen zu erstellen. Duke -Forscher haben den Schalter, können schalten Sporenbildung und schalten Sie Antibiotikaproduktion entdeckt.
Credit: US Centers for Disease Control and Prevention
Ihre Hoffnung wäre jetzt , um zu sehen , ob es möglich ist, diesen Schalter , um Antibiotika- Fabrik der Natur effizienter zu manipulieren.
Die Studie, veröffentlicht in Cell erscheint , festgestellt, dass ein einzigartiges Zusammenspiel zwischen einem kleinen Molekül namens zyklisches -di- GMP und einem größeren Protein namens BldD letztendlich steuert, ob ein Bakterium in einem vegetativen Zustand verbringt seine Zeit damit beschäftigt, oder bekommt Antibiotika.
Forscher stellten fest, daß das kleine Molekül assembliert in einer Art molekularer Klebstoff, Verbinden von zwei Kopien der BldD als geschlossene Einheit , die Entwicklung in den Gram- positiven Bakterien Streptomyces regulieren .
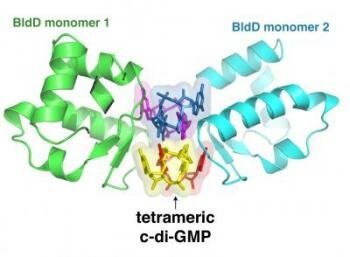
Duke Strukturbiologen haben eine einzigartige Interaktion zwischen einem kleinen Molekül namens zyklisches -di- GMP und einem größeren Protein namens BldD , die letztlich steuert, ob ein Bakterium, verbringt seine Zeit im Wachkoma oder machen Antibiotika gefunden.
Bildnachweis: Maria Schumacher, Duke University
"Seit Jahrzehnten haben Wissenschaftler fragen, was dreht das Entwicklungs- Schalter in Streptomyces , schalten Sie das normale Wachstum und die ungewöhnlichen Prozess der vielzelligen Differenzierung , in der sie erzeugt Antibiotika zu beginnen ", sagte Maria A. Schumacher , Ph.D. , Associate Professor für Biochemie an der Duke University School of Medicine. "Jetzt können wir nicht nur wissen, dass zyklische -di- GMP verantwortlich ist, aber wir wissen auch genau, wie es mit dem Protein interagiert BldD , um seine Funktion zu aktivieren. "
Streptomyces einen komplexen Lebenszyklus mit zwei Phasen : die Trenn , vegetativen Phase und eine deutliche Phase, in der die Bakterien bilden ein Netzwerk von fadenförmigen Filamenten zu kauen organischen Ablagerungen und produzieren Antibiotika und andere Stoffwechselprodukte . Am Ende dieser zweiten Phase , die Bakterien bilden filamentösen Zweige, die in die Luft erstreckt Spiraltürmeder Sporen schaffen .
Im Jahr 1998 entdeckten Forscher ein Gen, das kultiviert Streptomyces Bakterien aus der Schaffung dieser spiralförmigen Türme der Flaum auf ihrer Oberfläche gehalten . Sie fanden heraus, dass dieses Gen , dem sie den Namen BldD , um dieses " bald" Aussehen widerspiegeln , beeinflusst auch die Produktion von Antibiotika.
Nachfolgende Studien haben gezeigt, dass BldD ist ein besonderes Protein namens ein Transkriptionsfaktor , eine Art Master-Regulator , die DNA bindet und aktiviert oder deaktiviert mehr als hundert Gene , um biologische Prozesse wie die Sporenbildung zu steuern. Aber in mehr als einem Jahrzehnt der Forschung , hatte niemand in der Lage, die Köpfe hinter dem Betrieb zu identifizieren , die das Molekül , das letztlich steuert dieses Master-Regulator in Streptomyces .
Dann Wissenschaftler am John Innes Centre im Vereinigten Königreich - wo ein Großteil der Forschung über Streptomyces begann - entdeckt, dass das kleine Molekül zyklisches -di- GMP wird durch mehrere Transkriptionsfaktoren durch BldD geregelt erzeugt. Die Forscher haben einen Schnelltest , um zu sehen, ob dieses kleine Molekül würde sich binden BldD und waren erstaunt, dass es getan hat. Sie kontaktierten langjähriger Mitarbeiter Schumacher und Richard G. Brennan Ph.D. an der Duke , um zu sehen , wenn sie könnte einen genaueren Blick auf dieses wichtige Wechselwirkung zu nehmen.
Herzog Team verwendet ein Werkzeug , wie Röntgenkristallographie bekannt, ein atomarer Ebene dreidimensionale Struktur des BldD- (cyclic -di- GMP) Komplex zu schaffen.
BldD normalerweise existiert als ein einzelnes Molekül oder Monomer , aber wenn es Zeit ist, DNA zu binden und die Sporenbildung zu unterdrücken, es tut sich mit einer anderen Kopie von sich an die Arbeit machen. Die 3D-Struktur von den Forschern aufgebaut ergab, dass diese zwei Kopien BldD nie körperlich berühren, sondern sind durch vier Kopien von zyklischen -di- GMP stecken .
"Wir haben durch die Proteindatenbank gesucht und durchforstet unsere Erinnerungen , aber diese Erkenntnis scheint einzigartig zu sein ", sagte Brennan , der ein Professor und Vorsitzender der Biochemie an der Duke University School of Medicine ist . " Wir haben noch nie eine Art von Struktur vor , in der zwei Monomere zu einem funktionellen Dimer , ohne direkte Interaktion zwischen ihnen außer einer Art von niedermolekularen Klebe gesehen."
Um ihre Ergebnisse zu bestätigen , bestimmt Schumacher mehrere Kristallstrukturen aus verschiedenen Geschmacksrichtungen von Bakterien ( S. venezuelae und S. coelicolor ) und kam mit der gleichen ungewöhnlichen Ergebnis jedes Mal .
Nun, da die Forscher wissen, wie zyklische -di- GMP und BldD miteinander verklebt geworden , schalten Sie die Sporenbildung und schalten Sie Antibiotikaproduktion , sie würden gerne wissen, wie der Komplex unglued wieder werden , um den Schalter in die andere Richtung drehen .